Détermination de la constante d’Avogadro.

Résolution atomique observée sur un
monocristal d’or Image réalisée en microscopie à effet
tunnel. © CNRS Photothèque

Manipulation d’atomes sur une surface.
Ecriture nanométrique. IBM Almaden, USA
Amadeo Avogadro (1776 – 1856) n’est pas l’inventeur de la constante qui porte son nom. C’est Jean Perrin qui, en 1912, lui rend ainsi hommage comme promoteur de la théorie atomique.


La constante d’Avogadro est définie comme le nombre d’entités élémentaires qui se trouvent dans une mole. Sa valeur correspond par convention au nombre d’atomes de carbone dans 12 grammes de carbone 12.

Les premières déterminations le la valeur de la constante d’Avogadro remonte au début du XXème siècle. Jean Perrin dans son ouvrage « Les atomes » (1913), rapporte diverses méthodes :

Jean Perrin, Les atomes 1913 p.289.
Entre 1910 à 1917, sir J.J. Thomson et R.A. Millikan déterminent la valeur de la charge de l’électron. Une nouvelle estimation de la valeur de la constante d’Avogadro (6,06 x 1023 mol-1) est obtenue à partir de mesures électrochimiques.
Une illustration de ces méthodes est abordée dans le travail proposé ici.
Tous les documents nécessaires sont téléchargeables
à l’adresse DOCS (dossier avogadro).
Objectif : déterminer l’ordre de grandeur de la constante d’Avogadro à partir de l’électrolyse à anode soluble de cuivre.
Consigne : étude préalable individuel puis groupe de deux (30 minutes).
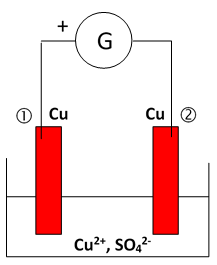
Individuellement : établir le fonctionnement chimique de l’électrolyse en s’appuyant sur le schéma ci-dessous ; on précisera les mouvements électroniques et les demi-équations redox aux électrodes. Établir la relation entre le nombre d’électrons qui circulent et le nombre d’atomes de cuivre « déplacés ». Prolonger le raisonnement pour obtenir la relation entre la quantité d’électricité qui a circulé pendant la durée de l’électrolyse et la masse de cuivre déplacée.
Mise en commun et comparaison en groupes de deux.
Animation tableau pour la mise au point.
Apport magistral : [quantite electricite.pptx]
Egalement utilisable : [electrolysis10.swf] http://group.chem.iastate.edu/Greenbowe/sections/projectfolder/flashfiles/electroChem/electrolysis10.swf
Protocole expérimental. (1 heure)
Matériel : générateur de tension continue (12 V – 1 A), rhéostat (33 W – 1 A), multimètre ; électrolyseur : bécher de 250 mL ; solution de sulfate de cuivre (II) à la concentration 1,0 mol.L-1 ; deux électrodes : plaques de cuivre.
– décapage des électrodes et pesée : polissage au papier abrasif ; dégraissage avec brosse et détergent ; décapage final sous la hotte dans l’acide nitrique à 5% pendant quelques secondes, rinçage et séchage ; numéroter et peser des deux électrodes (à 0,01 g près) ;
– préparation de l’électrolyseur et mise en fonctionnement : solution aqueuse de sulfate de cuivre (II) à la concentration molaire de 1,0 mol.L-1 dans le bécher 250 mL ; les électrodes plongent jusqu’à mi-hauteur ; agitateur magnétique en évitant que le turbulent heurte les plaques de cuivre lors de sa rotation.

– mettre le générateur sous tension et régler rapidement l’intensité du courant à 0,50 A.
Déclencher le chronomètre. La durée de l’électrolyse est fixée à 30 minutes. L’agitation constante de la solution est essentielle pour assurer la stabilité de l’intensité du courant ! Vérifier périodiquement.
– après l’électrolyse
Au bout de 30 minutes(ou d’une durée comparable et mesurée), ouvrir le circuit, extraire les deux plaques et les rincer à l’eau distillée. Observer l’état des deux électrodes. Sécher doucement les deux électrodes à l’aide d’un sèche-cheveux électrique. Peser à nouveau chaque électrode et calculer la variation de leur masse respective.
Exploitation des résultats groupes de deux (15 minutes).
A partir des mesures de masse et donc des variations de masse des plaques obtenir un ordre de grandeur de la constante d’Avogadro. (On donne : qe = 1,6 x 10-19 C ; MCu = 63,5 g.mol-1).
Un exemple de résultat : [exemple résultat.pdf]
Présentation des résultats et analyse critique : animation tableau pour la mise au point .
Listage les sources d’incertitude de mesures.
Autre source d’incertitude : les réactions chimiques « parasites » impliquant H2O et SO42-

Documents disponibles.
Tous ces documents sont téléchargeables
à l’adresse DOCS (dossier avogadro).

