
https://www.cnrs.fr/cnrs-images/chimieaulycee/THEMES/catalyse/defini.htm
Cristaux de zéolithes sur une surface en alumine vus au microscope électronique. Les zéolithes sont des composés minéraux de synthèse voisins des argiles. Leur structure microporeuse et leurs propriétés acides en font des catalyseurs très utilisés dans l’industrie, notamment pour la transformation des hydrocarbures (pétrochimie). © CNRS Photothèque.
—————————
Le terme de « catalyse ›› a été utilisé pour la première fois dans le sens moderne par Jöns
Jacob Berzelius en 1835. Mais le mode d’action des catalyseurs n’a été vraiment compris qu’après le développement de la cinétique chimique avec Wilhelm Ostwald (Nobel 1909). Un grand nom français : Paul Sabatier (Nobel 1912), auteur de << La Catalyse en Chimie Organique ››. Fritz Haber (Nobel 1918) a mis au point avant la guerre de 1914 un procédé à catalyse hétérogène permettant de synthétiser l’ammoniac (NH3) à partir d’hydrogène et de l’azote de l’air… et de cette façon permis à l’Empire allemand de prolonger son effort de guerre, car l’ammoniac, oxydé en nitrates, joue un rôle crucial dans la fabrication des explosifs. D’autres noms associés à la science des catalyseurs sont Irving Langmuir (Nobel 1932) ou Cyril Hinshelwood (Nobel 1956). […]
Société chimique de France. L’actualité chimique, mai 2002.
La vitesse d’une réaction peut être profondément modifiée par la présence d’une substance qui semble ne pas intervenir directement puisqu’on la retrouve inchangée en fin de réaction et qui agit généralement en faible proportion par rapport aux réactifs.
– Les catalyseurs sont des substances qui augmentent la vitesse d’une réaction.
– Les inhibiteurs diminuent la vitesse.
L’action du catalyseur s’explique par une diminution de l’énergie d’activation qui entraîne, à même température, une augmentation du coefficient de vitesse.
Maurice Griffé. Chimie.

Les caractéristiques générales de la catalyse sont maintenant bien définies. Une approche pluridisciplinaire associant les méthodes et techniques de la chimie physique, inorganique et organique, de la physique des surfaces et de la physique du solide et du génie chimique a permis d’établir le mécanisme de nombreuses réactions catalytiques : espèces intermédiaires, étapes élémentaires du cycle catalytique, caractéristiques des espèces ou sites actifs. La combinaison de cette connaissance scientifique et de techniques combinatoires permet d’accélérer la conception, l’optimisation et la fabrication de catalyseurs d’activité, sélectivité et stabilité optimales.
La science de la catalyse peut maintenant être considérée comme mature, ce qui ne l’empêche pas de continuer à innover, tant au niveau des concepts que des applications. À travers le développement de nouveaux catalyseurs, de nouvelles technologies pour leur préparation et leur mise en œuvre, cette capacité d’innovation devrait permettre de relever les grands défis de l’avenir que constituent la protection de l’environnement, l’amélioration de l’efficacité énergétique des procédés, la valorisation de nouvelles sources carbonées (biomasse).
[…] Victor Grignard (École Supérieure de Chimie Industrielle de Lyon) et Paul Sabatier (Institut de Chimie de Toulouse) furent ainsi co-lauréats du prix Nobel en 1912. En particulier, Paul Sabatier fut récompensé pour ses travaux sur la « Méthode d’hydrogénation de composés organiques en présence de métaux finement divisés » ; il était le deuxième prix Nobel récompensant la catalyse hétérogène après F.W. Ostwald en 1909: « Un catalyseur est un corps qui accélère la vitesse d’une réaction sans apparaître dans les produits finaux. » […]
La catalyse en général, et hétérogène en particulier, est très rapidement devenue un outil essentiel pour le développement de la chimie industrielle. Actuellement, 85 % des procédés industriels utilisés de par le monde sont de nature catalytique, 15 % seulement de nature stœchiométrique ; la proportion est encore bien plus importante si l’on considère les quantités de produits générés. En effet, la catalyse est au cœur de la production de masse des produits issus du raffinage, de la pétrochimie, de la chimie des grands intermédiaires et des commodités. Les procédés actuels sont basés à 80 % sur la catalyse hétérogène, à 17 % sur la catalyse homogène et à 3 % sur la biocatalyse. […]
Les grandes tendances actuelles d’intervention de la catalyse hétérogène sont :
– la production de vecteurs énergétiques : carburants synthétiques et reformulés, biocarburants… ;
– la chimie nouvelle comme outil du développement durable : économie d’atomes et d’énergie, utilisation du carbone renouvelable ;
– la dépollution ;
– les catalyseurs-réacteurs structurés du micron au millimètre pour l’intensification des procédés. […]
Parmi d’autres exemples, des mousses de carbure de silicium, excellent conducteur thermique très résistant à la corrosion et présentant des diamètres d’ouverture d’environ 300 µm, ont été enduites de catalyseur TiO2 pour des applications en catalyse liquide-solide. Dans un composant en silicium fabriqué avec les techniques de la microélectronique, chaque pilier de 5 x 60 µm a été recouvert d’un fin dépôt de γ-alumine (1 µm), sans bouchage du composant et sans sédimentation incontrôlée (figure 22). Cette alumine, un solide poreux très utilisé en catalyse, peut ensuite servir de support à des nanoparticules de platine afin de les stabiliser. Ce catalyseur est alors très performant dans des réactions très endothermiques de déshydrogénation en phase gazeuse.

Bernard Coq (coordinateur). Matériaux catalytiques et catalyse hétérogène. L’actualité chimique – 2010.
—————————————————–
Tous les documents nécessaires sont téléchargeables à l’adresse DOCS (dossier cinetique (5)).
——————————————————-
Les travaux de ce chantier portent sur l’interprétation de divers exemples de catalyses homogènes et hétérogènes. On aborde donc le rôle du catalyseur dans
la modification du chemin réactionnel, donc des espèces intermédiaires et des énergies d’activation. Le sujet n’est évidemment pas traité de façon exhaustive (ni dans sa complexité théorique) : par exemple, la catalyse enzymatique ou la notion de sélectivité ne sont pas abordées ici.
Un partie expérimentale donne à observer, de façon qualitative, plusieurs exemples classiques de catalyse :
[1-observations.pdf]

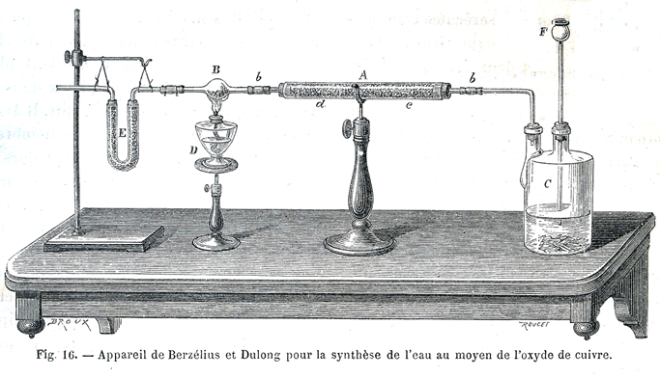
—————————————————
Cinq travaux portent sur l’interprétation. La consigne de travail individuel est donnée dans chaque document de travail. On le prolonge naturellement par une mise en commun en petit groupe puis une collecte des propositions et discussion sous forme d’animation tableau.
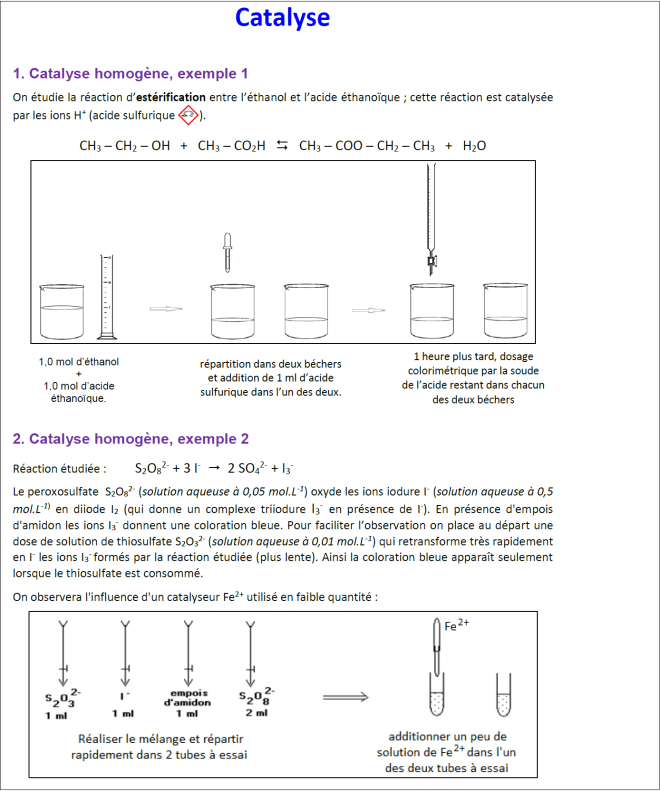
1. catalyse homogène de l’estérification par H+ :
[2-esterification.pdf]
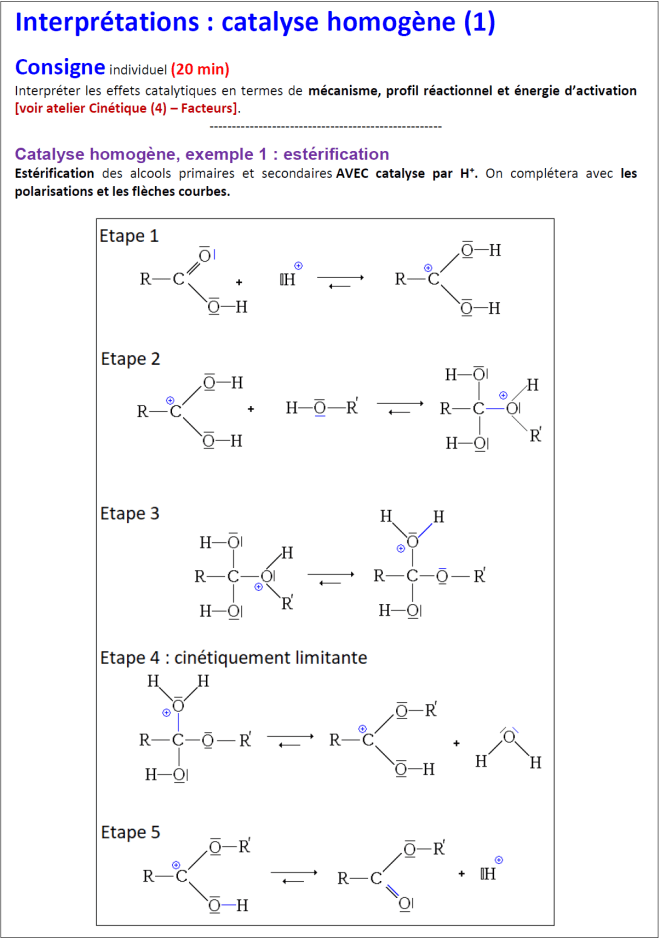




Voir aussi l’animation : [catalyse.exe] (© NCSSM 2002)


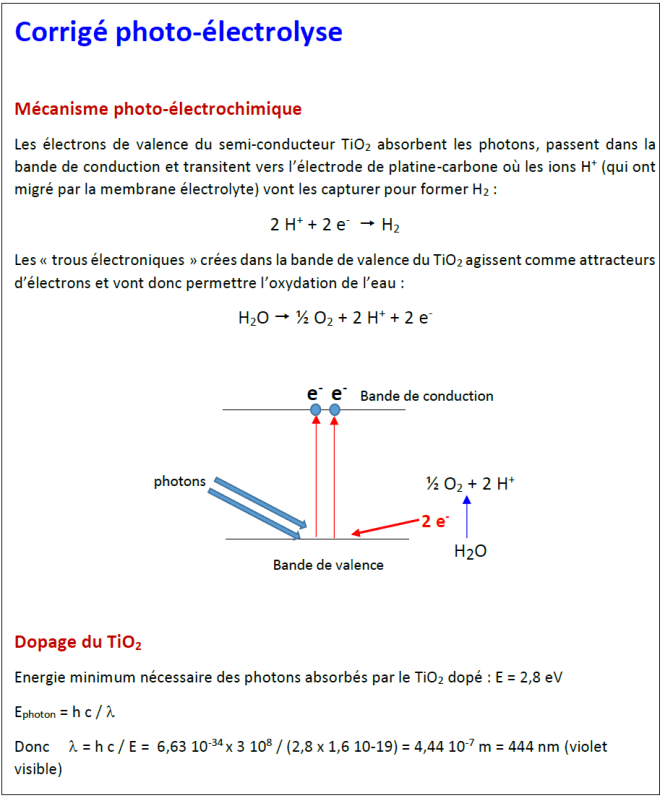
5. photocatalyse de la décomposition de l’eau :
[6-photocatalyse.pdf] et un corrigé [6-photo-corrige.pdf]
Ce contenu est également utilisé dans le chantier Dihydrogène.


Tous les documents nécessaires sont téléchargeables à l’adresse DOCS (dossier cinetique (5)).

————————————————————————
Une réflexion sur “Cinétique (5) – Catalyse”