A l’écoute des acides

Le tonneau de Schutzenbach, appareil en usage en Allemagne pour la fabrication du vinaigre. Les merveilles de l’industrie, 1873.
———————————–
Objectif. A partir des connaissances préalables sur les réactions d’échange de protons (théorie de Brønsted-Lowry des couples acide-base) et les notions de pH et conductivité (et les calculs correspondants), on aborde la question : une transformation chimique est-elle toujours totale ?
————————————————
Tous les documents nécessaires sont téléchargeables à l’adresse DOCS (dossier acide-base (2) deux acides).
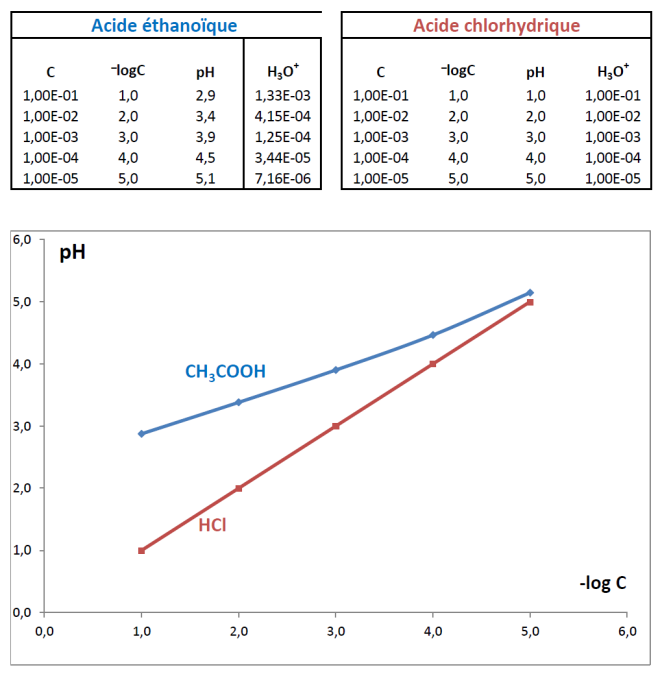
Document : [deux-acides.pdf]
Aide : définition du pH [pH.pdf]

Consigne 1 individuel (10 minutes)
Formulez votre (vos) hypothèse(s) permettant d’interpréter le comportement différent des deux solutions d’acide.
Animation tableau pour collecter et discuter les hypothèses.
Consigne 2 individuel puis groupe (50 minutes)
Travail individuel : déterminer la composition ioniquedes deux solutions à partir des résultats des mesures (on utilisera une présentation sous forme de tableau d’avancement).
Mise en commun et mis au point en groupe.
Animation tableau pour collecter les résultats à partir du document :[tableaux.pdf]
Discussion : l’(les) hypothèse(s) formulées au départ sont-elles convenables, suffisantes ?
Apport magistral :
Diaporama [deux acides.pptx] ou [deux acides.pdf]. Vocabulaire : acide fort et faible ; utilisation des symbolismes →, ← et D dans l’écriture des réactions chimiques. Interprétation au niveau microscopique : équilibre chimique dynamique.

On pourra aussi utiliser avec profit le diaporama : https://slideplayer.fr/slide/3698864/
Consigne 3 individuel (15 minutes)
Réinvestissement :acide fort ou acide faible ?

——————————————
Tous les documents nécessaires sont téléchargeables à l’adresse DOCS (dossier acide-base (2) deux acides).



——————————————————

