Théorie cinétique des gaz
ou
comment décrire le chaos

https://fr.wikipedia.org/wiki/Th%C3%A9orie_cin%C3%A9tique_des_gaz#/media/File:Translational_motion.gif Animation montrant l’agitation thermique affectant les molécules d’un gaz. Cinq d’entre elles sont colorées à seule fin de suivre plus facilement leur mouvement individuel. A. Greg (Greg L at English Wikipedia).
Francis Bacon (1561 – 1626) : l’essence même de la chaleur c’est le mouvement et rien d’autre chose. […] La chaleur est un mouvement expansif […] qui opère dans les molécules du corps.
René Descartes (1596 – 1650) : la quantité de chaleur qu’un corps dégage est la diminution de quantité de mouvement qui anime les petites parties de ce corps.
Robert Boyle (1627 – 1691) : la chaleur est le résultat d’un mouvement des constituants des matériaux et que ce mouvement devient plus important à mesure que la chaleur s’amplifie, ce mouvement étant désordonné.

En 1738 Daniel Bernoulli (1700 – 1782) publie Hydrodynamica. Il formule l’hypothèse qu’un gaz est constitué d’un très grand nombre de « molécules » se déplaçant dans toutes les directions, alors que les concepts d’atome ou de molécule ne sont pas encore admis à l’époque. Il considère que la pression d’un gaz est due aux chocs de ces molécules sur les parois du récipient qui le contient et que la température correspond à l’énergie de leur mouvement.
La théorie cinétique des gaz est attribuée à James Clerk Maxwell (1859) et Ludwig Boltzmann (1880). C’est une description mathématisée qui permet de relier les propriétés macroscopiques d’un gaz aux mouvements des « molécules » qui le constitue, à partir de deux idées initiales :
– l’agitation moléculaire : les molécules de gaz se déplacent librement dans tout le volume et subissent des chocs (des molécules entre elles ou des molécules contre les obstacles) qui modifient leur trajectoire ;
– le chaos moléculaire : la trajectoire d’une molécule est une marche au hasard.

Maxwell

Boltzmann
Selon Boltzmann, «dire que la théorie moléculaire n’a qu’une valeur historique, serait comme si un machiniste disait que l’organisation interne de sa machine n’a qu’une valeur historique» [Boltzmann 1903-1906, 295]. Il a, effectivement, toujours défendu l’idée que la physique et la science en général ne doivent pas s’efforcer simplement de sauver les phénomènes, mais également de comprendre les mécanismes internes qui sont responsables de leur occurrence et des lois de leur enchaînement. Mais les meilleures théories ne sont jamais que des images hypothétiques, que nous ne devons pas confondre avec la réalité elle-même.
JACQUES BOUVERESSE. La philosophie naturelle de Boltzmann. Philosophia Scienciae, tome 3, n°2 (1998-1999), p. 9-30
Boltzmann n’a jamais affirmé de façon inconditionnelle la réalité des atomes, mais n’a jamais non plus complètement nié leur existence. Il considérait les « images » atomiques comme des idéalisations utiles qui n’ont pas à correspondre entièrement à la réalité. À partir des années 1890, il a insisté de plus en plus sur les vertus pratiques de l’atomisme. Ainsi souligna-t-il à plusieurs reprises que l’usage d’images mécaniques est plus fécond heuristiquement que celui d’images électromagnétiques ou énergétistes. Dans cette perspective pratique, les atomes lui apparaissaient comme des images indispensables.
Anouk Barberousse. Ludwig Boltzmann, les théories physiques et les atomes. Institut d’Histoire et de Philosophie des Sciences et des Techniques, CNRS, Université Paris 1, ENS, Paris.
Tous les documents nécessaires sont téléchargeables à l’adresse DOCS (dossier atomisme (3)).
Consigne 1 individuellement(10 min)
Que se passe-t-il, pour un gaz, lorsqu’on lui fournit de la chaleur et que sa température augmente ? Expliquer par écrit.
Animation tableau pour la mise en commun.
Consigne 2 individuel puis en groupe(40 min)
Exploitation du document [capacité thermique molaire.pdf] capacité thermique molaire pour retrouver une valeur approximative de la constante de Boltzmann. Produire une affiche présentant la méthode et les résultats (utilisation possible d’un tableur).
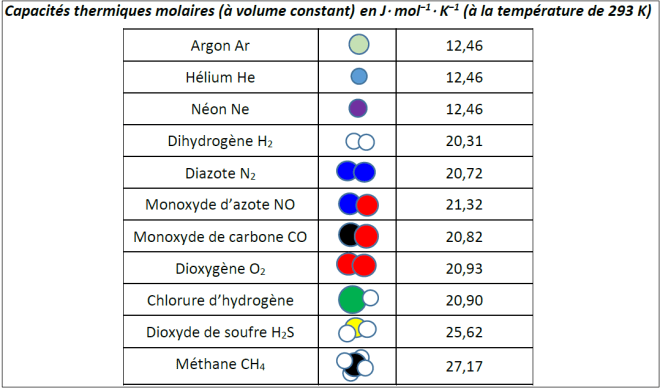
Présentations de plusieurs affiches (ou pages de tableur) et discussion.
Corrigé : [corrigé.xlsx] ou [corrigé.pdf] corrigé

Lectures complémentaires :
Documents : [complications.pdf] complications

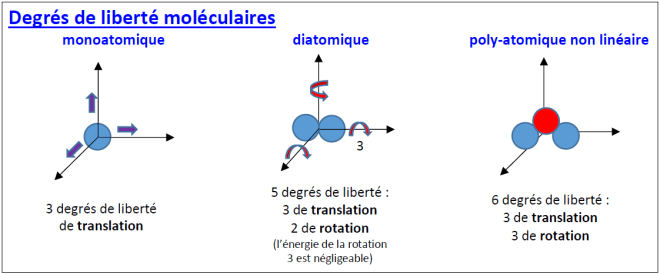
Degrés de liberté :
http://www.unice.fr/cdiec/cours/infra_rouge_FT/apprendre/ir_1/ir_1_07.htm
Historique : [historique.pdf] historique
Consigne 3 individuel puis mise au point en groupe (30 min)
Voir document de travail : [vitesse.pdf] vitesse
Vitesse quadratique moyenne des molécules. On trouve dans une publication les résultats suivants :
 http://lphe.epfl.ch/~mtran/phy_gen_B/Cours/Phys_214.pdf
http://lphe.epfl.ch/~mtran/phy_gen_B/Cours/Phys_214.pdf
Elaborer une méthode et l’exploiter pour vérifier ces résultats.
On pourra s’aider du document [capacité thermique.pdf] indiqué plus haut et des indications suivantes : v2 = vx2 + vy2 + vz2 ; pour chaque degré de liberté de translation (x, y, z) l’énergie cinétique moyenne est égale à ½ kB T ; constante de Boltzmann : kB = 1,381 × 10−23 J K−1 ; constante d’Avogadro : NA = 6,022 × 1023 mol−1
Corrigé : [corrige vitesse.xmlx] ou [corrige vitesse.pdf] corrige vitesse

Consigne 4 individuel puis mise au point en groupe (30 min)
Interprétation de la pression avec la théorie cinétique des gaz : il s’agit de compléter le document [pression.pdf] pression de façon à retrouver l’équation des gaz parfaits.
Extrait :
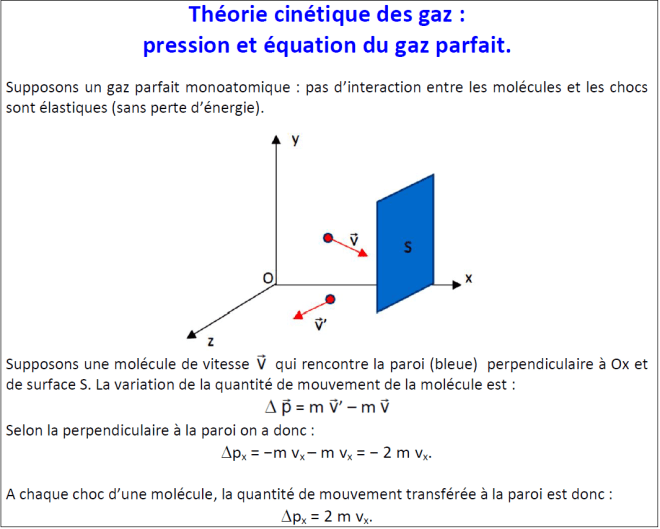
Corrigé : [pression corrige.pdf] pression corrige

Tous les documents nécessaires sont téléchargeables à l’adresse DOCS (dossier atomisme (3)).
