H2O2

https://fr.wikipedia.org/wiki/Peroxyde_d%27hydrog%C3%A8ne
Le peroxyde d’hydrogène possède à la fois des propriétés oxydantes par exemple vis-à-vis d’ions iodure et des propriétés réductrices par exemple vis-à-vis des ions permanganate. C’est un agent de blanchiment efficace. Il est utilisé comme antiseptique.

Le peroxyde d’hydrogène a été isolé pour la première fois en 1818 par Louis Jacques Thénard en faisant réagir du peroxyde de baryum avec de l’acide nitrique. Le procédé a pu être amélioré en utilisant de l’acide chlorhydrique à la place de l’acide nitrique, suivi par l’ajout d’acide sulfurique pour précipiter le sulfate de baryum comme sous-produit. Le procédé Thénard est utilisé de la fin du xixe siècle jusqu’au milieu du xxe siècle.
—————————————–
Tous les documents nécessaires sont téléchargeables à l’adresse DOCS (dossier cinetique (2)).
———————————————
On étudie ici la cinétique d’oxydation des ions iodure par l’eau oxygénée (peroxyde
d’hydrogène) ; on procède par dosage en continu du diiode formé par le thiosulfate S2O32-.
Deux versions sont disponibles.
– Un travail classique avec l’énoncé du protocole et les questions d’exploitation, et corrigé :
[1-iodometrie.pdf] ; [corrige.pdf]

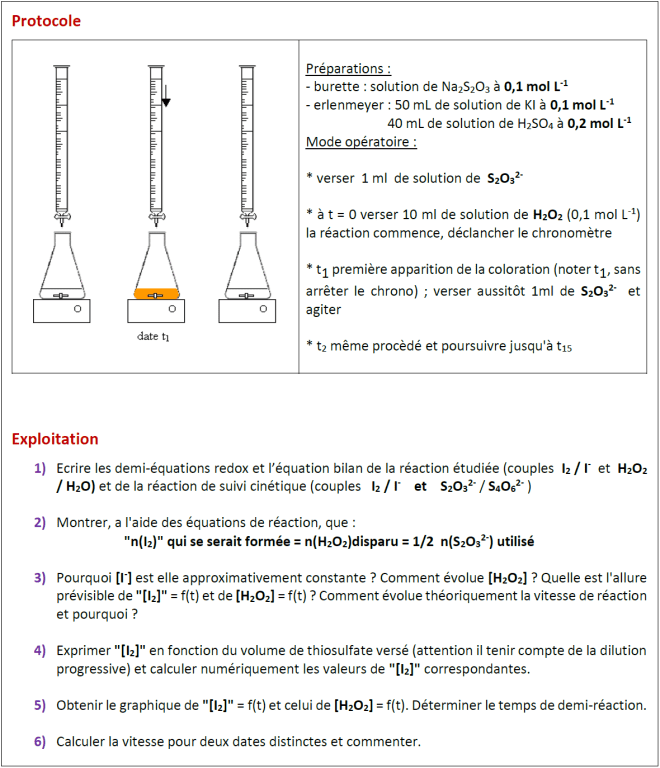
– La même situation présentée sous forme d’élaboration de protocole :
[2-iodometrie.pdf].

—————————————–
Tous les documents nécessaires sont téléchargeables à l’adresse DOCS (dossier cinetique (2)).

———————————————