
https://departments.kings.edu/chemlab/animation/nacl.html
—————————————————————————————–
http://agregation.a-l-chimie.fr/fichiers/peault/lx9_1.pdf
Lauriane Alexandrine. Le modèle du cristal ionique parfait et ses limites. Extrait.
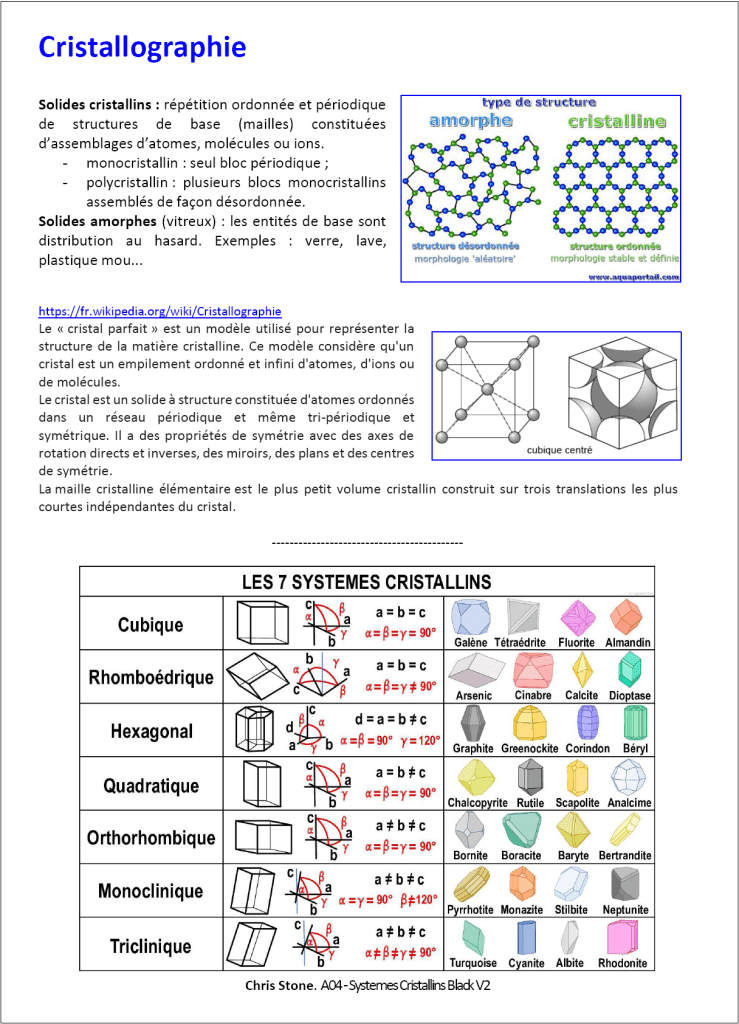
Modèle cristal parfait. On assimile les cations et les anions à des sphères dures (boules de billards) possédant un volume propre, caractérisés par leur rayon ionique, et une charge. La cohésion du cristal est assurée par l’interaction coulombienne entre les ions : elle est attractive entre les ions de mêmes signes, et répulsive sinon. L’interaction coulombienne attractive est forte ce qui implique une énergie de cohésion élevée pour ces cristaux (780 kJ/mol pour NaCl alors que dizaine kJ/mol pour cristaux moléculaires). Dès lors chaque ion s’entoure du nombre maximal d’ions de signe opposé (favorise l’interaction coulombienne). Il y a alors tangence entre anion et cation (sans interpénétration des nuages électroniques). Mais non contact entre les ions de mêmes signes (diminuer l’interaction coulombienne répulsive en 1/r2). En général le rayon ionique anionique (r-) est supérieur au rayon ionique cationique (r+), on parle alors de réseau hôte pour les anions et les cations viennent se placer dans les sites.
——————————
Tous les documents indiqués sont téléchargeables à l’adresse DOCS (dossier cristal (2) modeles)
——————————
Deux exemples classiques, le chlorure de sodium et le fer, pour aborder la modélisation des cristaux.
Documents de travail :
[1-chlorure-sodium.pdf]
[2-fer.pdf]

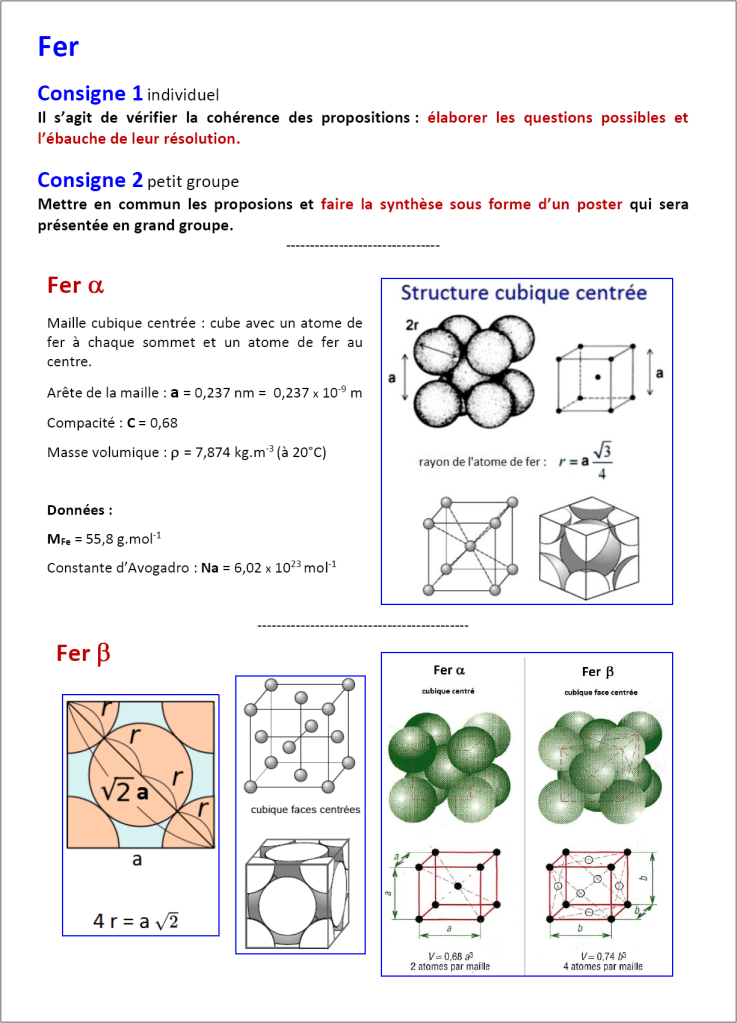
Documents complémentaires :
[definitions.pdf]
[maille.pdf]
[rayon-ionique.pdf]
[cristallographie.pdf]



——————————
Tous les documents indiqués sont téléchargeables à l’adresse DOCS (dossier cristal (2) modeles)
———————————————————————————————————————